Restauración del plazo de patente (PTE): cómo extender la vida útil de una patente farmacéutica
 feb, 2 2026
feb, 2 2026
¿Qué es la restauración del plazo de patente (PTE)?
La restauración del plazo de patente (PTE, por sus siglas en inglés) es un mecanismo legal que permite a las empresas farmacéuticas recuperar parte del tiempo de protección de su patente que se pierde mientras esperan la aprobación de la FDA. No es un truco ni un beneficio extra: es una compensación por el retraso que la burocracia impone en el camino de un medicamento desde el laboratorio hasta la farmacia.
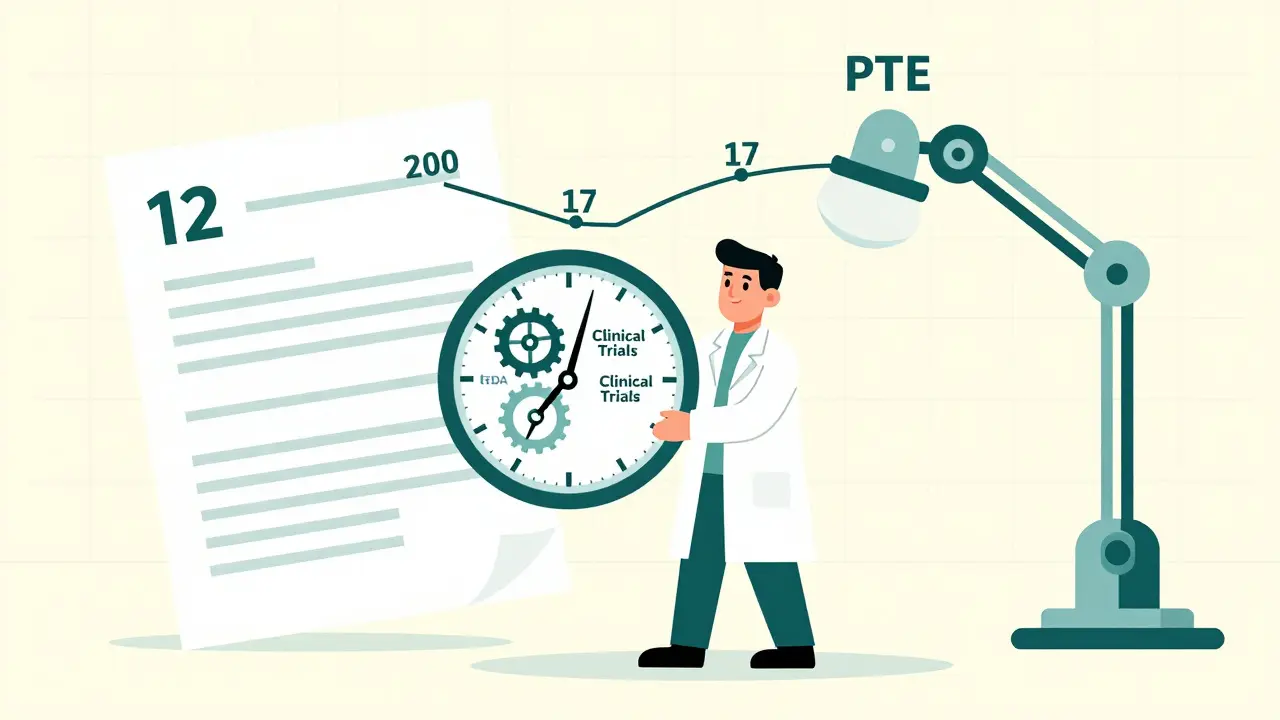
Imagina que inviertes 15 años y 2.600 millones de dólares en desarrollar un nuevo fármaco. Pasas 8 de esos años en ensayos clínicos, presentando documentos, respondiendo preguntas de la FDA, ajustando formulaciones. Al final, tu patente ya lleva 12 años de vida. Si la patente expira en 20 años desde su presentación, te quedan solo 8 años para recuperar tu inversión. Pero la FDA tardó 7 años en aprobarlo. Eso significa que tu monopolio real sobre el mercado es de apenas 1 año antes de que lleguen los genéricos. La PTE corrige ese desfase.
¿Cómo funciona la restauración del plazo de patente?
La PTE no es automática. Tienes que solicitarla, y solo si cumples con reglas estrictas. Se aplica a patentes que cubren productos humanos, dispositivos médicos, aditivos alimentarios o colorantes, siempre que hayan pasado por una revisión regulatoria antes de comercializarse. La ley que lo creó, la Hatch-Waxman Act de 1984, fue diseñada para equilibrar dos cosas: dar incentivos a las empresas innovadoras y permitir que los genéricos lleguen al mercado.
La fórmula para calcular la extensión es compleja, pero en esencia: se toma el tiempo total que tardó la FDA en revisar el producto, se le restan los días en que el solicitante no actuó con diligencia, y se aplica un límite. El máximo que puedes recuperar es 5 años. Y el plazo total de protección, incluyendo la extensión, nunca puede superar los 14 años desde la aprobación de la FDA.
Por ejemplo: si tu patente se presentó en 2010 y la FDA aprobó tu medicamento en 2020, tu patente expiraría en 2030. Pero si la FDA tardó 6 años en aprobarlo, y tú demostraste que trabajaste sin pausas, podrías obtener una extensión de 5 años. Eso te daría protección hasta 2035. Sin PTE, solo tendrías 10 años de exclusividad real. Con PTE, tienes 15.
¿Quién puede pedir una PTE y cuándo?
No cualquier patente califica. Solo las que cumplen tres condiciones clave:
- La patente aún no ha expirado cuando se solicita la extensión.
- La patente no ha recibido antes una extensión por el mismo producto.
- El producto fue sometido a una revisión regulatoria antes de su comercialización.
La solicitud debe presentarse dentro de los 60 días siguientes a la aprobación de la FDA. Ese plazo es inclemente. Si lo pierdes por un día, pierdes la oportunidad para siempre. Muchas empresas pierden millones porque sus equipos de patentes y regulaciones no se comunican bien. Un estudio de Nature Biotechnology encontró que el 43% de los retrasos en PTE se deben a malas coordinaciones entre departamentos.
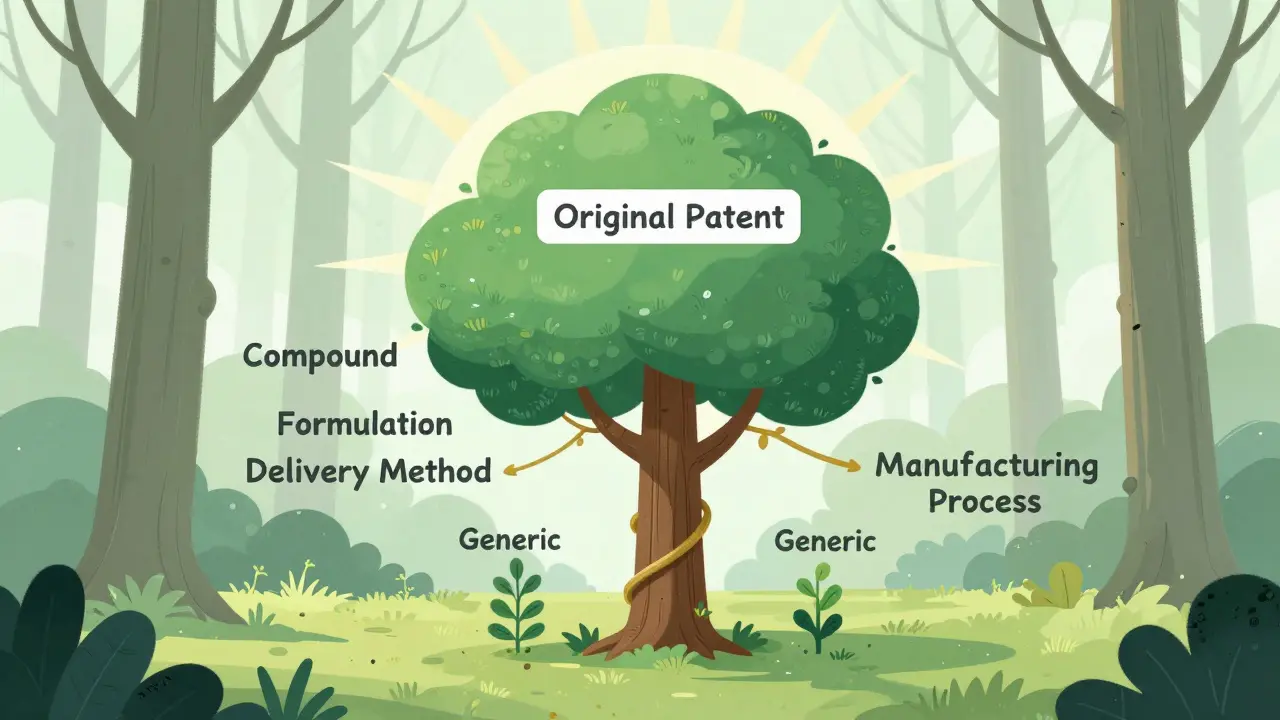
Además, solo se puede extender un patent por producto. No puedes extender cinco patentes para un solo medicamento. Eso evita que las empresas abusen del sistema. Pero aquí viene el detalle: muchas veces, las empresas extienden una patente secundaria -como una formulación, un uso o un método de administración- en lugar de la patente original del compuesto. Eso es legal, pero ha generado críticas.

¿Qué pasa con los genéricos? ¿No se retrasa la competencia?
Sí, y ese es el punto de tensión del sistema. La PTE fue diseñada para compensar retrasos regulatorios, no para crear monopolios eternos. Pero la realidad es distinta. Un estudio de la Yale Law and Policy Review en 2022 mostró que el 91% de los medicamentos que obtuvieron una extensión de patente siguieron manteniendo su monopolio gracias a otras patentes secundarias, acuerdos con genéricos o cambios en la formulación.
Según datos del Orange Book de la FDA, el 78% de las solicitudes de PTE en los últimos años no se refieren a la patente original del compuesto activo, sino a patentes derivadas: cómo se administra, qué excipientes se usan, o cómo se fabrica. Eso ha llevado a críticos como James Love de Knowledge Ecology International a decir que el sistema se ha convertido en una herramienta para crear "thickets de patentes" -una densa red de protección que ahoga la competencia.
El Congreso estadounidense ya ha intentado corregirlo. La Preserve Access to Affordable Generics and Biosimilars Act, propuesta en 2024, busca limitar ciertas estrategias de extensión. Pero hasta ahora, no ha pasado. Mientras tanto, los medicamentos con PTE mantienen un 92% de cuota de mercado durante el período extendido, según la FTC. Eso significa que los consumidores pagan más, y más tiempo.
Los errores que arruinan una solicitud de PTE
El 12,7% de las solicitudes de PTE son rechazadas. La razón principal: no se demuestra diligencia continua. La FDA no acepta “hice todo lo posible”. Necesita pruebas día por día. ¿Qué significa eso?
- Documentación de cada envío a la FDA.
- Correos electrónicos, actas de reuniones, fechas de respuesta.
- Pruebas de que no hubo pausas innecesarias en el proceso.
Un especialista en patentes en una gran farmacéutica lo dijo en Reddit en 2024: “El error más común es pensar que con un informe de hitos basta. No. Necesitas el historial completo, como si fueras un detective que reconstruye una cadena de eventos.”
Además, si tu patente se está reemitida (reissue), puedes pedir una suspensión de hasta seis meses en el proceso de PTE. Eso permite que la extensión se aplique a la nueva versión, no a la original. Es una estrategia avanzada, pero legal. Solo los abogados con experiencia en patentes farmacéuticas la usan.
El futuro de la PTE: ¿se acabará?
La PTE no va a desaparecer. Es parte del ecosistema farmacéutico desde 1984. Pero está bajo presión. La FDA está trabajando en una plataforma digital para simplificar las solicitudes, con lanzamiento previsto para el segundo trimestre de 2026. Eso podría reducir errores y acelerar procesos.
Al mismo tiempo, los costos están subiendo. La GAO (Oficina de Responsabilidad Gubernamental) publicará en diciembre de 2025 un informe completo sobre cómo la PTE afecta los precios de los medicamentos. Si el informe muestra que el sistema genera más gastos de lo necesario, podría haber cambios legislativos.
La tendencia actual muestra que más solicitudes vienen de productos biológicos -como anticuerpos monoclonales- que de medicamentos químicos tradicionales. En 2023, el 34% de las solicitudes de PTE fueron para biológicos, frente al 19% en 2018. Eso refleja cómo la industria ha cambiado: ya no se trata solo de píldoras, sino de tratamientos complejos y caros.
En 2024, un fallo judicial importante -Eli Lilly v. USPTO- endureció los estándares para demostrar diligencia durante la fase pre-aprobación. Esto podría reducir las extensiones promedio en 8 a 12 meses. Las empresas ya están ajustando sus estrategias. Ya no pueden contar con que la FDA tardará mucho y que eso les dará automáticamente más tiempo. Tienen que demostrarlo, con pruebas, día a día.
¿Vale la pena el esfuerzo?
Para una empresa farmacéutica, la respuesta es sí. Una extensión de 5 años puede significar más de 10.000 millones de dólares en ingresos. El mercado global de medicamentos llegó a 1,57 billones de dólares en 2024. El 78% de esos ingresos vienen de medicamentos de marca. La PTE es uno de los pilares que sostienen ese modelo.
Pero para el sistema de salud, la pregunta es más difícil. ¿Es justo que un medicamento que costó 2.600 millones de dólares siga siendo caro 15 años después? ¿O debería haber un equilibrio más claro entre innovación y acceso?
La PTE no es buena ni mala. Es un instrumento. Y como todos los instrumentos, depende de cómo se use. En manos de una empresa que realmente invirtió en innovación, es justa. En manos de una que lo usa para bloquear competencia, es problemática. El reto del futuro no es eliminarla, sino hacerla más transparente, más precisa y menos susceptible a abusos.
¿Cuánto tiempo puede extenderse una patente con PTE?
La extensión máxima permitida es de 5 años. Además, el plazo total de protección, incluyendo la extensión, no puede superar los 14 años desde la fecha de aprobación por la FDA. Esto significa que incluso si la FDA tardó 7 años en aprobar un medicamento, la extensión no puede ser mayor a 5 años, y el producto no puede tener más de 14 años de exclusividad comercial tras la aprobación.
¿Se puede solicitar PTE para dispositivos médicos?
Sí. La Ley Hatch-Waxman original incluyó no solo medicamentos humanos, sino también dispositivos médicos, aditivos alimentarios y colorantes. Sin embargo, la mayoría de las solicitudes (más del 80%) provienen del sector farmacéutico. Los dispositivos médicos requieren el mismo tipo de documentación, pero el proceso regulatorio suele ser más corto, lo que reduce la necesidad de extensión.
¿Qué pasa si se pierde el plazo de 60 días para solicitar PTE?
Si no se presenta la solicitud dentro de los 60 días posteriores a la aprobación de la FDA, se pierde la oportunidad para siempre. No hay excepciones. Eso es por lo que las empresas contratan equipos especializados que trabajan en paralelo con los departamentos de regulación. Un solo error administrativo puede costar millones en ingresos futuros.
¿La PTE se aplica en Europa o solo en EE.UU.?
La PTE tal como se describe aquí -con la fórmula y el marco legal de la Ley Hatch-Waxman- solo existe en Estados Unidos. En la Unión Europea, existe un mecanismo similar llamado Certificado de Protección Suplementaria (SPC), que también extiende la protección de patentes para medicamentos, pero con reglas distintas. Por ejemplo, en la UE, la extensión máxima es de 5 años, pero el plazo total no puede exceder 15 años desde la primera autorización de comercialización.
¿Cómo se demuestra la diligencia continua para una solicitud de PTE?
Se requiere un registro detallado de todas las actividades relacionadas con la aprobación regulatoria: fechas de envío de documentos, respuestas de la FDA, reuniones, revisiones internas, cambios en la formulación, y cualquier comunicación oficial. No basta con decir "trabajamos sin pausas". Se necesitan pruebas tangibles: correos electrónicos, archivos de sistemas internos, firmas de revisión, y registros de tiempos. La FDA exige que se muestre progreso continuo, día a día, desde la presentación del pedido hasta la aprobación.

