Historia de los medicamentos genéricos en Estados Unidos
 dic, 8 2025
dic, 8 2025
En 1984, solo uno de cada cinco medicamentos recetados en Estados Unidos era genérico. Hoy, más de 9 de cada 10 lo son. Pero esta revolución no ocurrió por casualidad. Fue el resultado de décadas de leyes, escándalos, presiones económicas y un sistema regulatorio que poco a poco aprendió a equilibrar innovación y acceso.
Los inicios: cuando los medicamentos eran un caos
Antes de 1906, cualquier persona podía vender lo que quisiera como "medicamento". No había estándares. No había etiquetas claras. No había control. En 1820, once médicos se reunieron en Washington, D.C., y crearon la primera lista de medicamentos aceptables: la U.S. Pharmacopeia. Era un intento de poner orden en el caos. Pero no era ley. Solo una guía voluntaria.
En 1848, el gobierno federal por fin intervino con la Drug Importation Act, que obligaba a inspeccionar los medicamentos que entraban desde el extranjero. Era un paso pequeño, pero crucial: reconocían que los productos contaminados podían matar. Y así fue. En 1937, un jarabe llamado Elixir Sulfanilamide, que contenía glicol de etileno -un antifreeze-, mató a 107 personas, la mayoría niños. El escándalo fue tan grande que obligó al Congreso a aprobar la Federal Food, Drug, and Cosmetic Act en 1938. Por primera vez, las empresas tenían que demostrar que sus medicamentos eran seguros antes de venderlos. La FDA, que hasta entonces solo podía actuar después de que alguien se enfermara, ahora tenía poder preventivo.
La era de la eficacia: antes de 1962, muchos medicamentos no funcionaban
La seguridad era importante, pero ¿y si el medicamento simplemente no hacía nada? Esa fue la pregunta que surgió en los años 50. Muchos fármacos aprobados antes de 1938 nunca habían sido probados para ver si realmente curaban algo. En 1962, tras el escándalo de la talidomida en Europa -que causó malformaciones en bebés-, el Congreso aprobó las Enmiendas Kefauver-Harris. Ahora, las empresas no solo tenían que probar que un medicamento era seguro, sino también que funcionaba. Y no solo los nuevos fármacos: todos los que ya estaban en el mercado desde 1938 tenían que volver a pasar por la prueba de eficacia.
Eso dejó en el aire miles de medicamentos. Algunos eran buenos. Otros, inútiles. Pero el sistema no estaba diseñado para producir versiones baratas de esos fármacos. Las farmacéuticas no tenían incentivos para copiarlos. Y los pacientes seguían pagando precios altos por lo que a menudo era un remedio igual al de otra marca, solo con un nombre diferente.

El gran cambio: el Acto Hatch-Waxman de 1984
Todo cambió con el Drug Price Competition and Patent Term Restoration Act, conocido como el Acto Hatch-Waxman. Era un acuerdo político inteligente: daba a las empresas innovadoras un poco más de tiempo de exclusividad (hasta 5 años extra de patente) a cambio de abrir la puerta a los genéricos. Y esa puerta era el ANDA -la Solicitud Abreviada de Nuevo Fármaco.
Antes de 1984, un fabricante de genéricos tenía que hacer todo lo mismo que la empresa original: estudios clínicos costosos, pruebas en humanos, ensayos de seguridad. Era imposible competir. El ANDA cambió eso. Ahora, solo tenían que demostrar que su medicamento era bioequivalente: que se absorbía en el cuerpo de la misma manera, en la misma cantidad, y producía los mismos efectos. No necesitaban repetir los ensayos. Solo necesitaban un laboratorio, un análisis químico y un poco de coraje.
El resultado fue inmediato. En 1984, los genéricos representaban el 19% de las recetas. En 2022, eran el 90,5%. Y eso no es solo un número. Es dinero en el bolsillo de los pacientes. En 2021, los genéricos ahorraron al sistema de salud estadounidense $373 mil millones. En los últimos diez años, más de $3,7 billones.
El costo de la eficiencia: escasez y precios volátiles
Pero el éxito tuvo un lado oscuro. Al reducir tanto los costos de producción, muchas empresas dejaron de fabricar medicamentos genéricos que no eran rentables. Algunos eran baratos de hacer, pero con poca demanda. Otros, como medicamentos para enfermedades raras o con ingredientes difíciles de obtener, se volvieron vulnerables.
Entre 2018 y 2022, la FDA registró 1,234 escaseces de medicamentos. El 65% de ellas eran de genéricos. No porque fueran de mala calidad -sino porque nadie los fabricaba. El mercado se volvió tan competitivo que algunas empresas simplemente se retiraron. Y cuando hay pocos productores, el precio puede subir de golpe. Entre 2013 y 2017, el 15% de los genéricos aumentaron su precio más del 100%, aunque en promedio los precios bajaban.
Algunos de esos aumentos no fueron por costos de producción. Fueron por especulación. Empresas compraban fábricas enteras de medicamentos genéricos y luego subían los precios, sabiendo que nadie más los fabricaba. La FDA y el Congreso intentaron frenarlo. En 2019, aprobó la CREATES Act, que impide a las empresas de marca bloquear el acceso a muestras de sus medicamentos, algo que usaban para retrasar la entrada de genéricos.
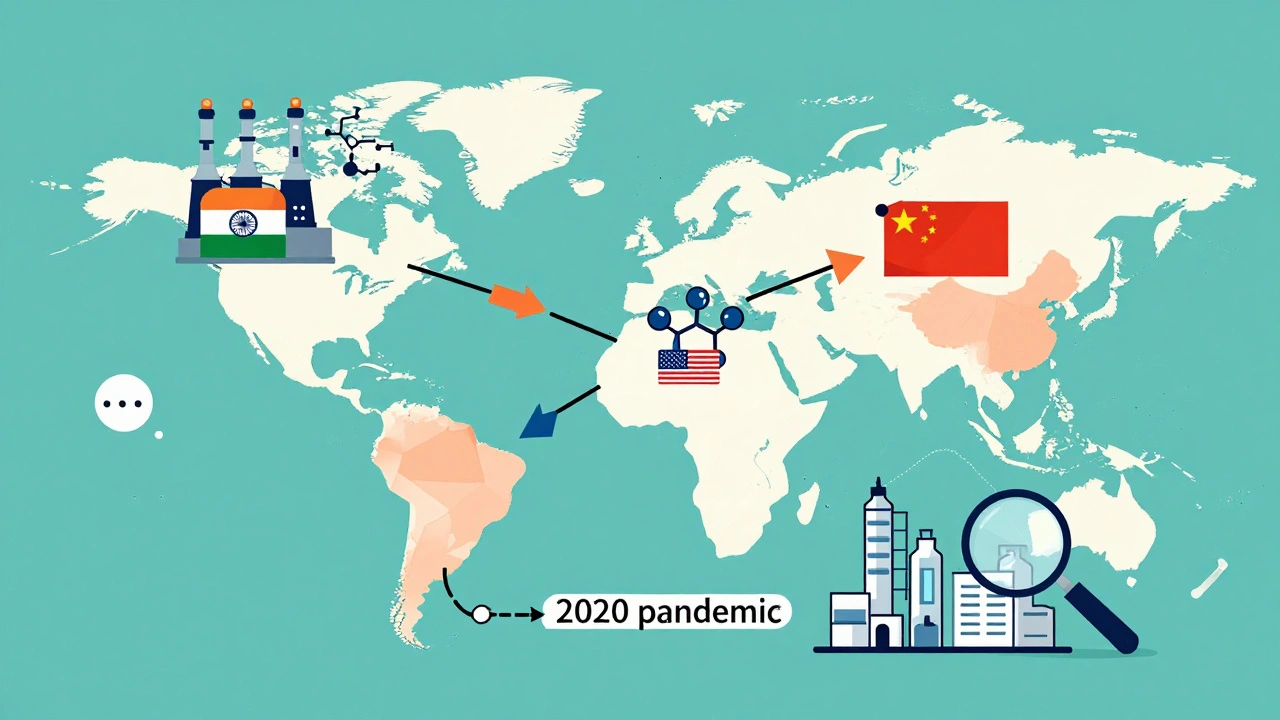
La cadena global: ¿quién fabrica tus medicamentos?
Si tomas un medicamento genérico hoy, es muy probable que su ingrediente activo venga de la India o de China. El 80% de las instalaciones que producen ingredientes farmacéuticos activos (API) están fuera de Estados Unidos. Eso es eficiente. Pero también frágil. Durante la pandemia, los cierres en Asia causaron escaseces de antibióticos, anticoagulantes y medicamentos para la presión arterial. No era un problema de calidad. Era un problema de logística. El sistema depende de una cadena global que puede romperse por un bloqueo, un huracán o una guerra.
La FDA inspecciona más de 13,000 fábricas en todo el mundo. Pero no puede estar en todas partes. Y no siempre tiene acceso a los registros. En 2022, la agencia encontró más de 1,000 violaciones de buenas prácticas de manufactura en plantas de India y China. Algunas fueron corregidas. Otras, no. Y los medicamentos seguían llegando.
El futuro: biosimilares y más competencia
El próximo gran paso no es otro genérico. Es un biosimilar. Mientras que los genéricos copian medicamentos químicos simples, los biosimilares intentan replicar medicamentos biológicos -como los que tratan el cáncer, la artritis o la diabetes tipo 1-. Son más complejos, más caros de producir, y más difíciles de copiar. Pero ya están llegando. En 2025, se espera que los biosimilares empiecen a reducir drásticamente los precios de medicamentos que cuestan hasta $200,000 al año por paciente.
La FDA aprueba alrededor de 900 ANDAs cada año. El tiempo de revisión cayó de 30 meses en 2012 a solo 10 meses en 2023. El sistema funciona. Pero sigue siendo vulnerable. Las empresas de marca siguen usando trampas legales: demandas por patentes de dudosa validez para extender monopolios por 30 meses. Eso retrasa la entrada de genéricos, aunque la FDA ya haya aprobado el producto.
La historia de los medicamentos genéricos en Estados Unidos no es solo una historia de ciencia. Es una historia de poder, dinero y política. De cómo un sistema diseñado para proteger a los pacientes terminó siendo una herramienta para ahorrar vidas -y dinero-. Hoy, los genéricos no son la segunda opción. Son la opción principal. Y sin ellos, millones de estadounidenses no podrían pagar sus medicamentos.
¿Qué significa que un medicamento sea bioequivalente?
Que se absorbe en el cuerpo de la misma manera que el medicamento de marca, en la misma cantidad y con el mismo efecto. No tiene que ser idéntico en color, forma o sabor, pero sí en cómo funciona. La FDA exige pruebas rigurosas para garantizarlo.
¿Por qué los genéricos son tan baratos?
Porque no tienen que pagar por investigación, desarrollo ni campañas de publicidad. Solo necesitan demostrar que copian fielmente el medicamento original. Eso reduce los costos hasta en un 85% en comparación con los medicamentos de marca.
¿Son tan seguros como los medicamentos de marca?
Sí. La FDA exige que los genéricos cumplan con los mismos estándares de calidad, pureza y potencia que los medicamentos de marca. Se fabrican en las mismas instalaciones, a menudo por las mismas empresas. La única diferencia es el nombre y el precio.
¿Por qué hay escasez de medicamentos genéricos?
Porque algunos medicamentos genéricos tienen márgenes de ganancia tan bajos que las empresas dejan de fabricarlos. Si pocos pacientes los usan, o si el precio es demasiado bajo, no vale la pena producirlos. Eso crea vacíos en el mercado.
¿Qué es el Acto Hatch-Waxman y por qué es importante?
Fue la ley de 1984 que creó el camino legal para que los genéricos entraran al mercado sin repetir ensayos clínicos. Estableció el ANDA y equilibró la protección de patentes con la competencia. Sin ella, los genéricos como los conocemos hoy no existirían.
¿Pueden los medicamentos genéricos tener diferentes efectos secundarios?
No por el ingrediente activo. Los efectos secundarios vienen del fármaco en sí, no del nombre. Pero algunos pacientes reportan diferencias por los ingredientes inactivos -como colorantes o conservantes-. Es raro, pero posible. Si notas un cambio, habla con tu farmacéutico o médico.


Gabriel Peña
diciembre 9, 2025 AT 13:39En Colombia, los genéricos son la única opción para mucha gente. No es una cuestión de preferencia, es de supervivencia. Mi abuela toma tres medicamentos genéricos y nunca tuvo problemas, pero sí tuvo que elegir entre comer bien o pagar la receta. La ley Hatch-Waxman fue un milagro, aunque ahora veo que los precios vuelven a subir por trampas legales. No es justo.
Paulina Pocztowska
diciembre 11, 2025 AT 11:59¡Ay, Dios mío, qué historia tan loca!! 😭 Yo en España lo vi de cerca: mi tío se murió por un medicamento falso en los 90… y ahora, con los genéricos, casi no me acuerdo de lo caro que era todo… pero ojo, que en algunos sitios, los genéricos son tan baratos que hasta dudas si sirven… ¡pero la FDA los controla! ¡Y eso es oro puro! 🙌
Juan Martín Perazzo
diciembre 13, 2025 AT 04:05En Argentina, los genéricos son una bendición… pero también una pesadilla. Por un lado, te salvan la vida. Por otro, hay veces que no los encuentras porque nadie los produce. La cadena global es un hilo de seda: rompe uno y se cae todo. Y sí, la FDA inspecciona, pero no puede estar en todas partes. ¿Cómo confiar en un medicamento que viene de un laboratorio que no ves ni sabes dónde está? Es difícil, pero no hay alternativa.
luisana paredes
diciembre 14, 2025 AT 17:22Me encanta cómo explicaste esto. Es como una historia de justicia, pero con pastillas. ¿Sabes? A veces pienso que la salud no debería ser un negocio. Pero como no podemos cambiar eso, al menos que los genéricos existan. Que alguien, en algún lugar, decida que es más importante salvar vidas que hacer dinero. Eso, para mí, es un pequeño milagro.
jonathan martinez
diciembre 15, 2025 AT 13:28El ANDA fue el cambio real. Antes, copiar un medicamento era como intentar abrir una caja fuerte sin saber la clave. Después, solo necesitabas la misma llave. Y eso abrió el mercado. Hoy, el 90% de las recetas son genéricas porque funciona. No es magia, es ingeniería regulatoria bien hecha.
melissa perez
diciembre 16, 2025 AT 04:03Los genéricos no son la segunda opción, son la única opción que tiene el 80% del mundo. Los ricos se compran los de marca para sentirse seguros, pero los pobres sobreviven con los genéricos. Y eso es una vergüenza. No es un logro del sistema, es una falla. Si tu vida depende de una pastilla que cuesta 2 dólares, tu dignidad ya está en deuda.
gina tatiana cardona escobar
diciembre 17, 2025 AT 14:29Me encanta que la FDA haya mejorado tanto el tiempo de revisión 😊 de 30 meses a 10… eso es un cambio real! Y los biosimilares van a ser el siguiente gran paso… ojalá bajen los precios de los de cáncer… 🤞💖
Saira Guadalupe Olivares Zacarias
diciembre 18, 2025 AT 04:00Todo esto suena bonito pero es pura ilusión… los genéricos no son iguales, lo sé por experiencia… mi hermana tuvo crisis por un genérico que le dieron en el hospital… y después volvió al de marca y todo mejoró… entonces no, no son lo mismo… la FDA dice que sí, pero la ciencia no miente… y si te pasa a ti, no te van a devolver tu salud… y eso que dicen de bioequivalencia es un cuento para dormir a los pobres… los laboratorios se ríen de nosotros… y los políticos también…
Lucia Kuhl
diciembre 19, 2025 AT 20:00El hecho de que los ingredientes vengan de la India o China me da escalofríos… pero al mismo tiempo, ¿qué otra opción tenemos? 🤷♀️🌍 Si no fuera por eso, los medicamentos costarían el doble… pero también es una bomba de tiempo… un solo bloqueo y millones se quedan sin tratamiento… qué mundo tan raro.