Cómo funciona la aprobación de medicamentos genéricos por la FDA: una guía clara
 ene, 12 2026
ene, 12 2026
Si alguna vez has recibido un medicamento genérico en la farmacia, probablemente te hayas preguntado: ¿es realmente igual que el de marca? La respuesta corta es sí. Pero detrás de ese sí hay un proceso riguroso, bien regulado y diseñado para protegerte. La FDA -la Administración de Alimentos y Medicamentos de Estados Unidos- no aprueba un medicamento genérico porque sea más barato. Lo aprueba porque cumple con los mismos estándares de seguridad, eficacia y calidad que el original.
¿Qué es un medicamento genérico?
Un medicamento genérico es una versión de un fármaco que ya está en el mercado bajo marca comercial. Contiene la misma sustancia activa, en la misma cantidad, y se administra de la misma forma: pastilla, cápsula, inyección, etc. Por ejemplo, si tomas ibuprofeno, es probable que estés tomando un genérico. El nombre comercial original podría ser Advil o Motrin, pero el ingrediente activo es siempre el mismo: ibuprofeno.
Lo que cambia es el nombre, el color, la forma o el sabor -cosas que no afectan cómo funciona el medicamento. Estos cambios son permitidos porque la FDA solo exige que la sustancia activa sea idéntica. Los excipientes (los ingredientes inactivos como rellenos o colorantes) pueden variar, pero no deben alterar la absorción ni la acción del fármaco.
¿Cómo consigue la FDA que un genérico sea seguro y efectivo?
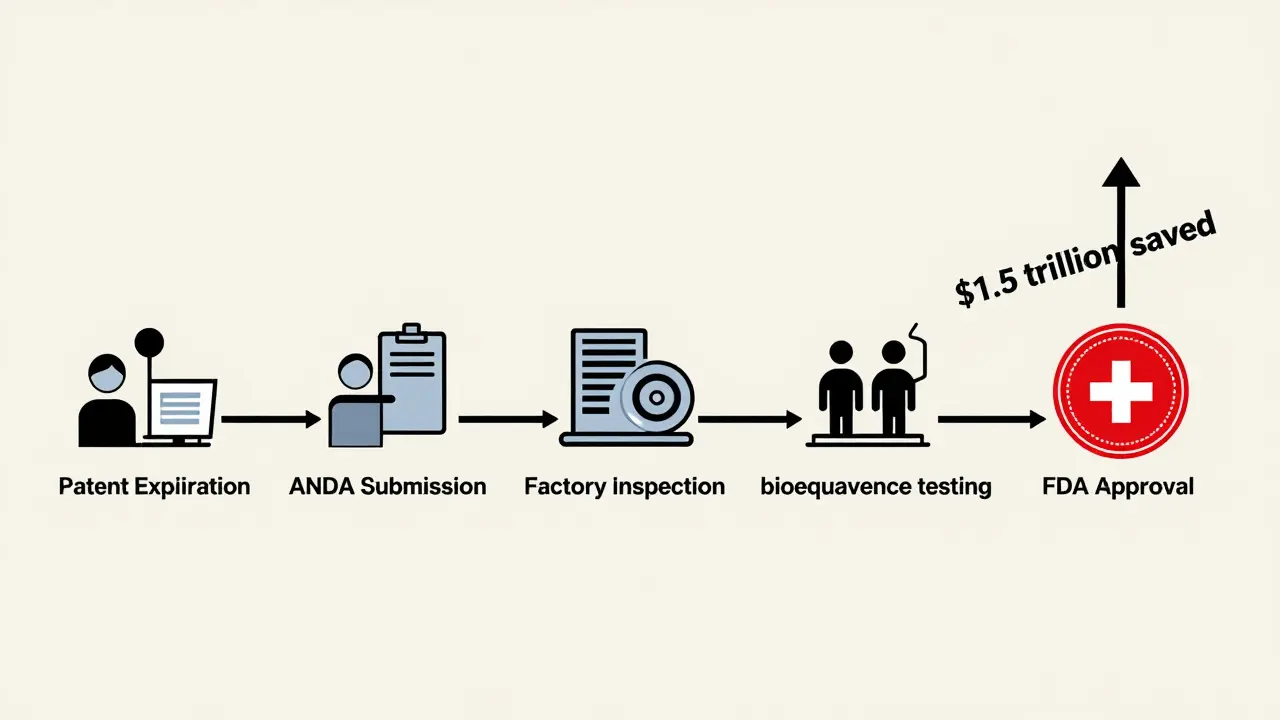
La FDA no pide a las empresas que repitan los estudios clínicos que ya se hicieron para el medicamento de marca. En su lugar, exige un camino más corto llamado ANDA -Solicitud de Nuevo Fármaco Abreviada. Este proceso se creó en 1984 con la Ley Hatch-Waxman, y desde entonces ha permitido que miles de medicamentos genéricos lleguen al mercado.
Para aprobar un genérico, la empresa debe demostrar dos cosas clave:
- Equivalencia farmacéutica: El genérico debe tener la misma sustancia activa, la misma dosis, la misma forma (por ejemplo, comprimido de 200 mg) y la misma vía de administración (oral, tópica, inyectable) que el medicamento de referencia.
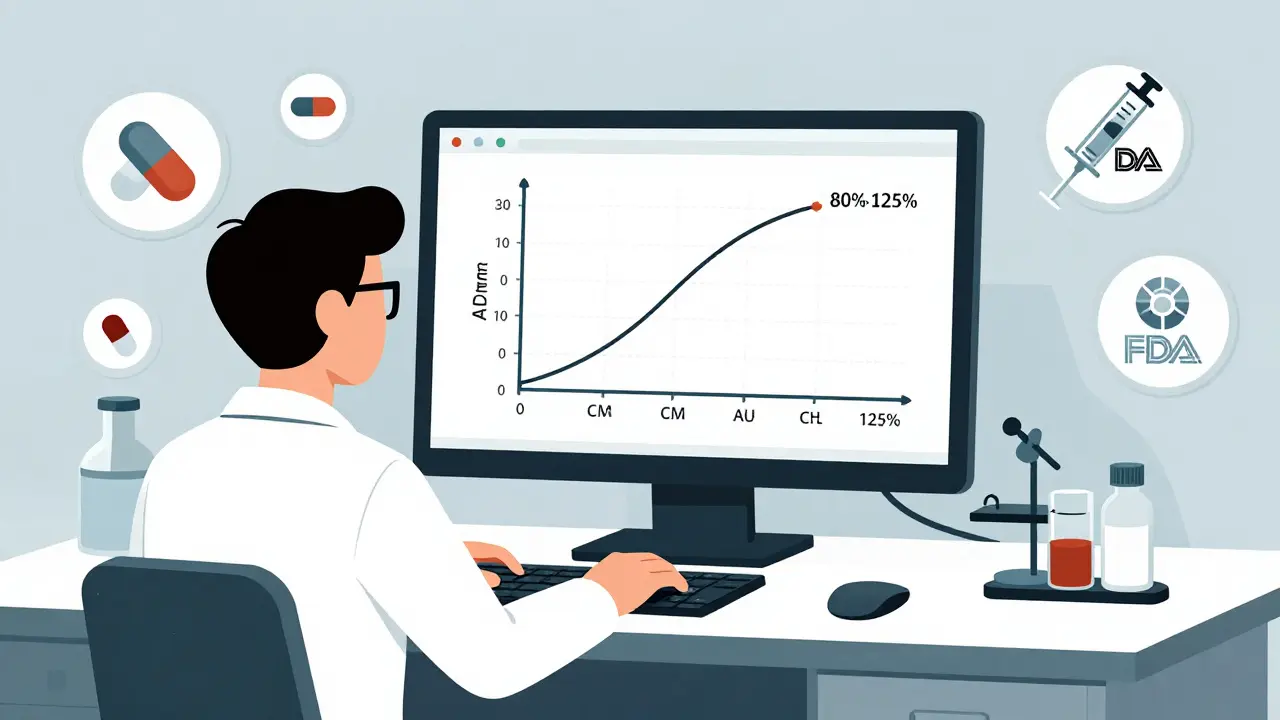
- Bioequivalencia: El genérico debe liberar la sustancia activa en el cuerpo a la misma velocidad y en la misma cantidad que el original. Esto se prueba con estudios en 24 a 36 personas sanas. Se mide cuánto del fármaco entra en la sangre (AUC) y cuál es su concentración máxima (Cmax). La FDA exige que estos valores estén entre el 80% y el 125% de los del medicamento de marca.
Esto no es una aproximación. Es una prueba científica rigurosa. Si un genérico no cumple con estos límites, la FDA lo rechaza. No hay excepciones.
¿Cuánto tiempo tarda en aprobarse un genérico?
El proceso no es rápido, pero sí predecible. La FDA se compromete a revisar el 90% de las solicitudes de genéricos en menos de 10 meses, según las metas establecidas en GDUFA III (2023-2027). Pero esto aplica solo a medicamentos sencillos, como pastillas o cápsulas.
Los medicamentos complejos -como inhaladores, cremas tópicas o suspensiones oculares- tardan mucho más. A veces, más de 24 meses. Por qué? Porque es más difícil demostrar que funcionan igual. Por ejemplo, no basta con medir la cantidad de fármaco en la sangre; hay que asegurarse de que llegue al pulmón, a la piel o al ojo en la misma forma que el original. La FDA lanzó en 2023 una iniciativa especial para mejorar la aprobación de estos productos, y ya ha publicado 18 guías específicas para ayudar a los fabricantes.
En 2023, la FDA aprobó 90 nuevos genéricos. Eso es un promedio de casi tres por semana. Y muchos de ellos son para medicamentos muy usados, como los que tratan la presión arterial, el colesterol o la tiroides.
¿Por qué son tan baratos?
El costo de desarrollar un medicamento de marca puede superar los $2.600 millones. Eso incluye décadas de investigación, miles de pacientes en ensayos clínicos, y miles de pruebas de laboratorio. Un genérico no necesita hacer eso. Solo necesita copiar el fármaco y demostrar que funciona igual. Por eso, su desarrollo cuesta entre $5 y $10 millones.
Esto se traduce en ahorros reales. En 2023, los medicamentos genéricos representaron el 90% de todas las recetas emitidas en EE.UU., pero solo el 23% del gasto total en medicamentos. Eso significa que, gracias a los genéricos, los pacientes y el sistema de salud ahorraron más de $1,5 billones en una década.
¿Son todos los genéricos iguales?
En términos de eficacia y seguridad, sí. Pero hay una excepción importante: los medicamentos con índice terapéutico estrecho. Estos son fármacos donde una pequeña variación en la dosis puede causar efectos graves. Ejemplos: la levothyroxina (para la tiroides), la warfarina (anticoagulante) o la fenitoína (para convulsiones).
En estos casos, algunos pacientes reportan cambios cuando cambian de marca de genérico a otra. No es porque uno sea malo. Es porque el cuerpo puede reaccionar a pequeñas diferencias en la forma en que se absorbe el medicamento, aunque esté dentro de los límites legales. Por eso, muchos médicos recomiendan que, si un paciente está estable con un genérico específico, no lo cambien sin razón.
La FDA reconoce esto. Por eso, en su estudio de experiencia del paciente en 2022, el 87% dijo estar satisfecho con los genéricos. Pero el 18% de quienes toman medicamentos de índice terapéutico estrecho expresaron preocupación. No es un problema del sistema, sino una necesidad de atención personalizada.
¿Qué pasa con las patentes?
Una de las razones por las que los genéricos no aparecen inmediatamente después de que un medicamento de marca sale al mercado es porque las empresas de marca protegen sus productos con patentes. Algunas incluso usan tácticas para retrasar la entrada de genéricos, como presentar nuevas patentes por cambios menores en la fórmula -algo llamado "evergreening".
La ley permite a las empresas de genéricos desafiar esas patentes. Si lo hacen y ganan, pueden recibir 180 días de exclusividad en el mercado, lo que significa que son los únicos que pueden vender ese genérico durante ese tiempo. Por eso, muchas veces varias empresas presentan su ANDA al mismo tiempo para un medicamento popular. En 2022, el 72% de las primeras solicitudes de genéricos incluían una disputa de patente.
La FDA no toma partido. Solo revisa si el genérico cumple con los requisitos técnicos. Las disputas legales se resuelven en los tribunales, no en la FDA.
¿Cómo puedo saber si mi medicamento es genérico?
En la etiqueta del frasco, el nombre del medicamento será el nombre genérico (por ejemplo, metformina), no el comercial (como Glucophage). En Estados Unidos, las farmacias deben ofrecer el genérico si está disponible, a menos que el médico lo prohíba explícitamente.
Si quieres verificar si un medicamento tiene una versión genérica, puedes consultar la Orange Book -una base de datos pública de la FDA que lista todos los medicamentos aprobados, con sus equivalentes genéricos y el estado de las patentes. No necesitas ser experto para usarla: basta con buscar el nombre del medicamento.
¿Qué pasa si el genérico no funciona como esperaba?
Si notas un cambio en cómo te sientes después de cambiar a un genérico -por ejemplo, más fatiga, mareos, o que tu condición parece empeorar- no lo ignores. Habla con tu médico o farmacéutico. No asumas que es "tu imaginación". Puede ser una reacción a un cambio en los ingredientes inactivos, o a una variación en la absorción.
La FDA tiene un sistema para reportar efectos adversos. Si tienes dudas, puedes reportar tu experiencia en línea. Eso ayuda a la agencia a identificar patrones y, si es necesario, revisar la aprobación de un genérico.
¿Qué significa esto para ti como paciente?
Que puedes confiar en los medicamentos genéricos. Son una de las mayores innovaciones en salud pública de las últimas décadas. Te permiten acceder a tratamientos esenciales sin tener que elegir entre tu salud y tu bolsillo.
La FDA no aprueba genéricos por economía. Los aprueba porque son científicamente equivalentes. Y si un medicamento genérico llega a tu farmacia, significa que pasó por más de 10.000 páginas de documentación técnica, inspecciones de fábricas, y pruebas en humanos. No es un producto de segunda categoría. Es un producto regulado con la misma intensidad que el original.
La próxima vez que te den un genérico, no lo veas como una "alternativa barata". Vealo como una prueba de que el sistema funciona: la ciencia, la regulación y el interés público están alineados para darte lo mejor, a un precio justo.
¿Son los medicamentos genéricos tan efectivos como los de marca?
Sí. La FDA exige que los medicamentos genéricos tengan la misma sustancia activa, la misma dosis, la misma forma y la misma vía de administración que el medicamento de marca. Además, deben demostrar bioequivalencia: es decir, que se absorben en el cuerpo de la misma manera. Estudios independientes y revisiones sistemáticas han confirmado que los genéricos tienen la misma eficacia clínica que los originales.
¿Por qué algunos pacientes dicen que los genéricos no les funcionan igual?
En la mayoría de los casos, no es que el genérico sea menos efectivo. Algunas personas que toman medicamentos con índice terapéutico estrecho -como levothyroxina o warfarina- pueden notar pequeñas diferencias cuando cambian de fabricante, porque los ingredientes inactivos o la forma de liberación pueden variar ligeramente. Esto no significa que el genérico sea inseguro, pero sí que, en estos casos, es mejor mantenerse con el mismo producto si ya funciona bien. Si notas cambios, habla con tu médico.
¿La FDA inspecciona las fábricas de medicamentos genéricos?
Sí. Todas las fábricas que producen medicamentos genéricos -tanto en EE.UU. como en el extranjero- deben cumplir con las normas de Buenas Prácticas de Manufactura (cGMP). La FDA realiza alrededor de 1.500 inspecciones al año. Si una fábrica no cumple, la FDA puede rechazar la aprobación o incluso prohibir la importación del medicamento.
¿Cuánto tiempo tarda en salir un genérico después de que expira la patente?
Para medicamentos simples, como pastillas, un genérico puede salir en promedio 14 meses después de que expira la patente. Pero si hay disputas legales o si el medicamento es complejo (como un inhalador), puede tardar varios años más. La FDA no puede forzar a una empresa a lanzar un genérico, pero sí puede acelerar su revisión si cumple con todos los requisitos técnicos.
¿Puedo confiar en los genéricos importados?
Sí, si están aprobados por la FDA. Muchos genéricos se fabrican en países como India o China, pero si la FDA los aprueba, significa que pasaron por las mismas pruebas y inspecciones que los fabricados en EE.UU. La FDA inspecciona fábricas en todo el mundo. Lo que importa no es dónde se hace, sino si cumple con los estándares de la FDA.
¿Qué sigue en el futuro?
La FDA está trabajando en nuevas herramientas para acelerar la aprobación de genéricos complejos. En 2025, planea usar inteligencia artificial para revisar solicitudes, lo que podría reducir tiempos de espera. También está impulsando la fabricación continua -una tecnología que mejora la calidad y reduce costos.
El mercado de genéricos crecerá. Con la edad de la población y el aumento de enfermedades crónicas, más personas necesitarán medicamentos asequibles. Los genéricos no son solo una opción económica. Son una parte esencial del sistema de salud moderno.
La próxima vez que recetas un medicamento genérico, recuerda: no estás eligiendo algo de menor calidad. Estás eligiendo un medicamento que pasó por el mismo filtro científico que el original -y que te permite vivir mejor sin sacrificar tu presupuesto.


alonso mondaca
enero 13, 2026 AT 23:23Me encanta este tipo de contenido claro y bien explicado 🙌 Realmente no sabía que la FDA exigía pruebas tan rigurosas para los genéricos. Ahora entiendo por qué confío en ellos, y no solo por el precio. Gracias por desmitificar esto!
Rene Salas
enero 14, 2026 AT 12:27Claro, todo esto suena bonito en teoría, pero la realidad es que muchos genéricos son fabricados en fábricas con estándares cuestionables, y la FDA no puede inspeccionar todo. La confianza ciega es peligrosa.
JM Cano
enero 14, 2026 AT 15:15El comentario de @6748 tiene un punto, pero es exagerado. La FDA inspecciona más de 1.500 fábricas al año, incluyendo muchas en India y China. Si un genérico está en el mercado estadounidense, pasó por controles tan duros como los de los de marca. No es cuestión de confianza ciega, es cuestión de datos.
alberto chavez
enero 16, 2026 AT 07:12Yo tenía miedo de usar genéricos por eso de los excipientes, pero después de leer esto, me di cuenta de que lo que me pasaba antes era pura psicología. Cambié a un genérico de metformina y ni me di cuenta. Lo importante es que funcione, no el nombre en la caja.
Manuel Pérez Sánchez
enero 17, 2026 AT 19:28¡Esto es lo que necesitamos más en redes! Información clara, basada en ciencia, sin sensacionalismos. Los genéricos son un triunfo de la salud pública. Si tu médico te receta uno, no lo rechaces por prejuicios. Tu bolsillo y tu cuerpo te lo agradecerán 💪
Laura Battley
enero 18, 2026 AT 03:53Me preocupa profundamente que se normalice el uso de medicamentos genéricos sin una supervisión más estricta. ¿Qué pasa con los pacientes vulnerables? ¿No es irresponsable sugerir que todos pueden intercambiarlos sin consecuencias? La ética médica exige cautela, no pragmatismo.
Brittney Fernandez
enero 18, 2026 AT 12:07OMG esto es tan importante!! 🤯 Yo no sabía que el 90% de las recetas son genéricas pero solo el 23% del gasto?? Eso es un MILLON de vidas salvadas por ahorro!! 🙏 La FDA es la heroína que nadie celebra!!
Alicia Gallofré
enero 18, 2026 AT 20:23Lo que más me impactó de este post no fue la ciencia detrás de la bioequivalencia -aunque es fascinante- sino cómo el sistema, a pesar de sus imperfecciones, logra equilibrar innovación, acceso y seguridad. La FDA no es perfecta, pero sí es una de las pocas instituciones que realmente prioriza al paciente por encima de los intereses corporativos. Y eso, en un mundo donde todo se monetiza, es casi milagroso. Lo que me gustaría ver es que esta transparencia se extendiera a otros países, especialmente en Europa, donde aún hay mucha desconfianza infundada. A veces, la resistencia a los genéricos no viene de la falta de información, sino de una cultura que asocia el precio con el valor, como si una pastilla más barata tuviera menos alma. Pero la ciencia no tiene clase social. Y eso, queridos, es lo que realmente debería hacernos sentir orgullosos.