Recientes aprobaciones de genéricos autorizados: opciones disponibles en 2025
 dic, 7 2025
dic, 7 2025
Si has recibido un medicamento que parece exactamente igual al de marca, pero con un nombre diferente y un precio más bajo, es probable que sea un genérico autorizado. A diferencia de los genéricos tradicionales, estos no son copias similares: son el mismo medicamento, fabricado por la misma empresa que produce la marca original, solo con otro envase y etiqueta. En 2025, el número de nuevos genéricos autorizados ha caído drásticamente, pero los que sí llegan al mercado siguen siendo una opción clave para pacientes que necesitan estabilidad en su tratamiento.
¿Qué es realmente un genérico autorizado?
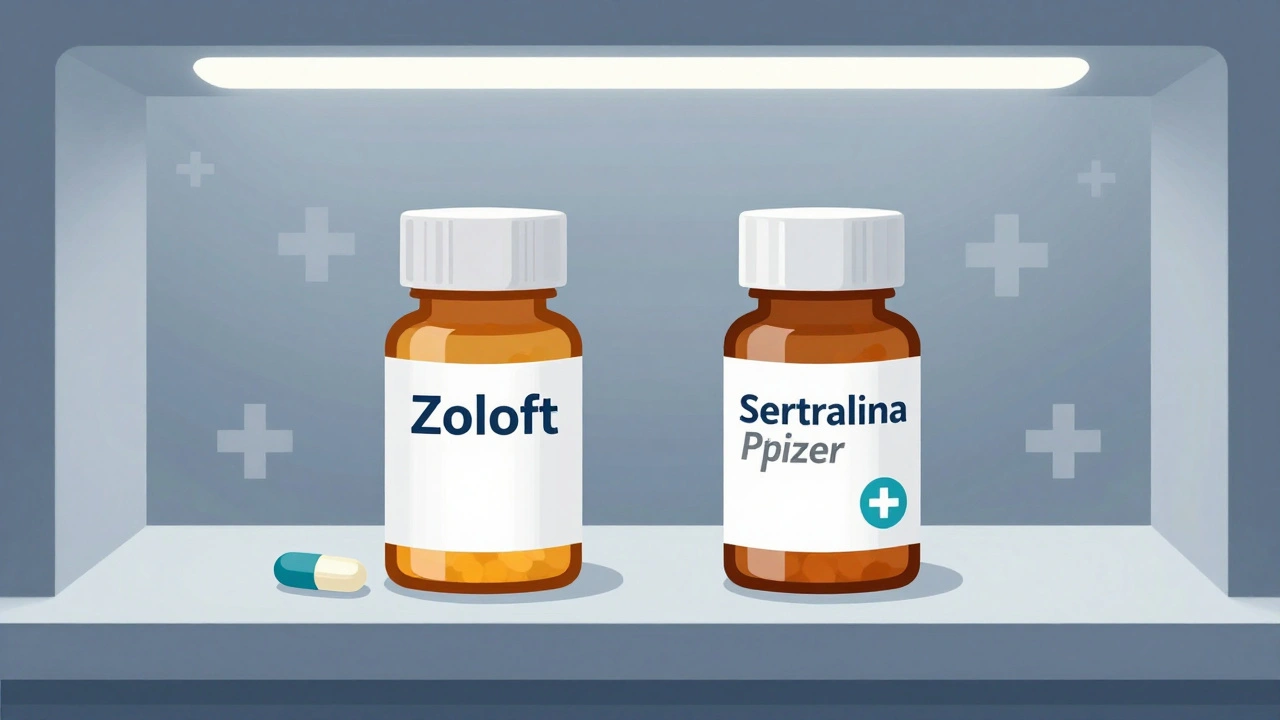
Un genérico autorizado es idéntico al medicamento de marca en todos los aspectos: misma fórmula activa, mismos ingredientes inactivos, misma forma farmacéutica, misma dosis y mismo mecanismo de acción. La única diferencia es que no lleva el nombre de la marca. Por ejemplo, si la empresa Pfizer vende el antidepresivo sertralina bajo el nombre de Zoloft, puede lanzar una versión genérica autorizada con el mismo contenido, pero etiquetada como "Sertralina Pfizer" o simplemente "Sertralina" con otro logotipo. La FDA lo define como un medicamento aprobado bajo una solicitud original (NDA) que se vende con etiquetado, empaque o código diferente al de la marca, pero sin cambiar su composición.
Esto lo diferencia completamente de los genéricos tradicionales, que deben pasar por una solicitud abreviada (ANDA) y pueden tener ingredientes inactivos distintos -como rellenos o colorantes- que, aunque no afectan la eficacia, sí pueden causar reacciones en pacientes sensibles. Un estudio de JAMA Internal Medicine en 2024 encontró que los pacientes que pasan de un medicamento de marca a un genérico tradicional reportan más efectos secundarios leves, especialmente con fármacos de índice terapéutico estrecho, como los antiepilépticos o los anticoagulantes. En cambio, con los genéricos autorizados, esos problemas prácticamente desaparecen.
¿Por qué han disminuido los genéricos autorizados?
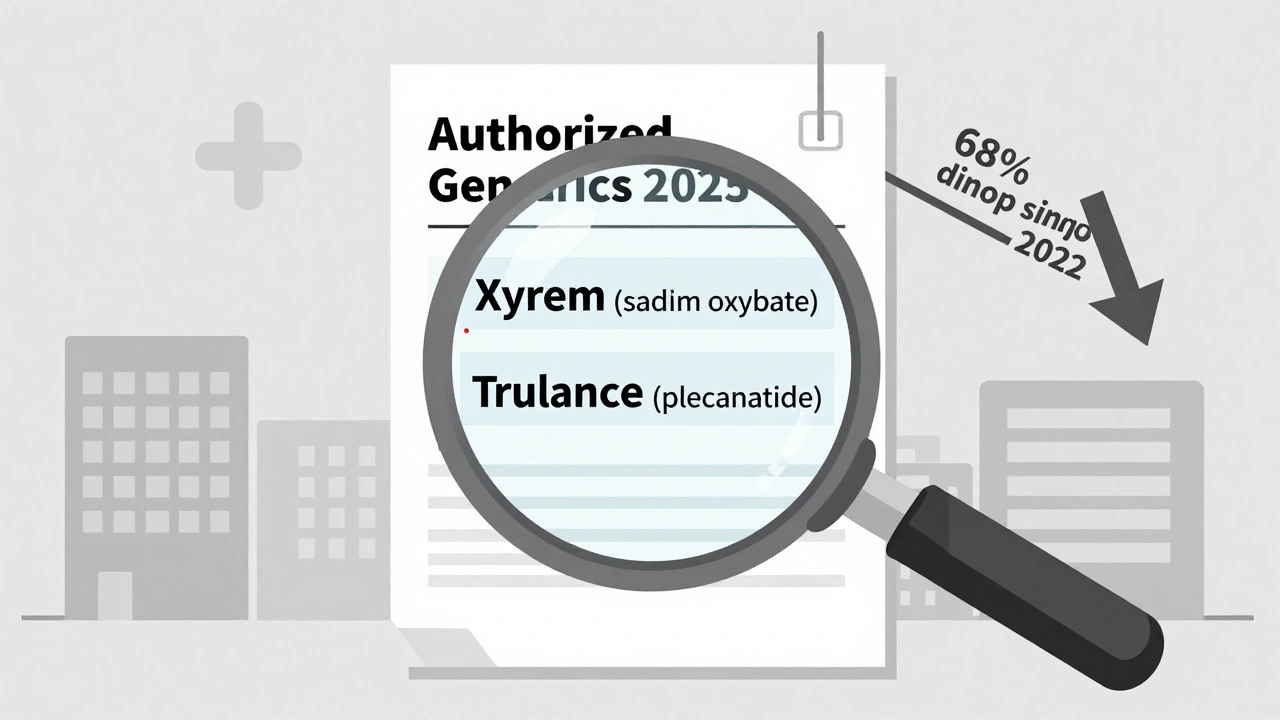
En 2022, la FDA aprobó 37 nuevos genéricos autorizados. En 2025, solo 12. Esa caída del 68% no es casual. Se debe a una presión regulatoria creciente. La Comisión Federal de Comercio (FTC, por sus siglas en inglés) ha intensificado su vigilancia sobre lo que se llama "acuerdos de pago para retrasar la competencia". Estos son acuerdos entre empresas de marca y productores de genéricos donde la marca paga al genérico para que no entre al mercado. En muchos casos, las empresas de marca usan genéricos autorizados como una forma de mantener el control del mercado: lanzan su propia versión genérica a un precio ligeramente más bajo, lo que desalienta a otros competidores de entrar.
En 2023, la FTC logró un acuerdo de $1.200 millones contra Teva por este tipo de práctica con el medicamento Copaxone. Desde entonces, las empresas farmacéuticas han sido más cautelosas. En lugar de lanzar genéricos autorizados, muchas prefieren invertir en biosimilares -versiones de medicamentos biológicos que, aunque no son idénticos, pueden competir en el mismo espacio terapéutico con menos riesgo legal.
En 2025, se aprobaron cinco biosimilares intercambiables para Stelara (ustekinumab), pero ningún genérico autorizado. Esto marca un cambio estratégico en la industria: las empresas ya no ven en los genéricos autorizados una forma de proteger sus ganancias, sino un riesgo regulatorio.
¿Cuáles son los genéricos autorizados disponibles en 2025?
Aunque son pocos, los nuevos genéricos autorizados aprobados en 2025 incluyen dos productos clave:
- Xyrem (sodium oxybate): Ahora disponible como genérico autorizado por Jazz Pharmaceuticals. Este medicamento se usa para tratar la narcolepsia y las cataplejías. Su versión genérica autorizada mantiene exactamente la misma formulación, pero con un empaque y nombre diferente.
- Trulance (plecanatide): Distribuido por Ironwood Pharmaceuticals bajo una nueva etiqueta. Se prescribe para el estreñimiento crónico idiopático y el síndrome del intestino irritable con estreñimiento.
Estos son los únicos dos nuevos genéricos autorizados que aparecieron en la lista actualizada de la FDA en octubre de 2025. No hubo otros lanzamientos significativos en los primeros nueve meses del año. La lista total de genéricos autorizados en Estados Unidos sigue siendo de 1.247 productos, pero la mayoría fueron aprobados entre 2010 y 2020.
Es importante no confundirlos con los genéricos tradicionales. Por ejemplo, en 2025 se aprobaron múltiples versiones de denosumab (usado para osteoporosis y cáncer óseo), como Ospomyv, Xbryk y Bildyos. Pero estos no son genéricos autorizados: son genéricos tradicionales, fabricados por otras compañías, con fórmulas ligeramente distintas en ingredientes inactivos. Lo mismo pasa con los biosimilares de Stelara: Otulfi, Selarsdi, Yesintek y Pyzchiva. Todos son medicamentos nuevos, no copias exactas.

¿Por qué no son más baratos?
Una de las razones por las que los genéricos autorizados no se han vuelto más populares entre los pacientes es su precio. A diferencia de los genéricos tradicionales, que pueden costar hasta un 80% menos que la marca, los genéricos autorizados suelen estar solo entre un 10% y un 15% por debajo del precio original. ¿Por qué? Porque la empresa de marca controla ambos productos. No hay competencia real entre versiones. Ellos deciden cuánto bajar el precio -y muchas veces, solo lo hacen lo suficiente como para disuadir a otros genéricos, no para beneficiar al paciente.
Un análisis de Health Affairs en febrero de 2025 mostró que, en muchos casos, los seguros médicos prefieren cubrir los genéricos tradicionales, incluso si son ligeramente diferentes, porque sus administradoras de beneficios (PBMs) obtienen mejores rebajas de las compañías que producen esos genéricos. En Reddit, un usuario compartió que su plan de salud, Blue Cross Blue Shield, eliminó la cobertura del genérico autorizado de Jardiance -a pesar de que es idéntico al original- porque el PBM había negociado un mejor descuento con el fabricante del genérico tradicional.
En Drugs.com, los pacientes que usan el genérico autorizado de Lyrica (pregabalina) reportan que es tan efectivo como la marca, pero muchos dicen que solo cuesta $5 menos por receta. Para muchos, ese ahorro no justifica el cambio de empaque o la confusión con el nombre.
¿Cómo saber si estás tomando un genérico autorizado?
La confusión es común. Ni los farmacéuticos ni los pacientes siempre saben cuándo están recibiendo un genérico autorizado. La FDA no exige que se marque explícitamente en el empaque. Según una encuesta de la Asociación Americana de Farmacéuticos en 2025, el 63% de los farmacéuticos no pueden identificar un genérico autorizado sin consultar la lista oficial de la FDA. Eso significa que muchos pacientes reciben consejos innecesarios sobre "sustitución" cuando en realidad están tomando el mismo medicamento que antes.
La mejor forma de verificarlo es revisar la lista de genéricos autorizados de la FDA, disponible en su sitio web. Busca el nombre de la marca y mira si aparece una línea con el mismo nombre del fabricante. Si es así, es un genérico autorizado. También puedes preguntar directamente a tu farmacéutico: "¿Este medicamento es fabricado por la misma empresa que hace la marca?". Si responden que sí, es probable que sea un genérico autorizado.
Algunas compañías, como Pfizer y Novartis, han comenzado a incluir frases como "Versión idéntica a [Nombre de Marca]" en sus empaques, pero esto aún no es un estándar.
¿Vale la pena usarlos?
Para ciertos pacientes, sí. Si has tenido problemas con genéricos tradicionales -como efectos secundarios inesperados, pérdida de eficacia o reacciones a ingredientes inactivos-, un genérico autorizado puede ser tu mejor opción. Son especialmente útiles para medicamentos con índice terapéutico estrecho, donde pequeñas variaciones en la formulación pueden causar grandes diferencias en el cuerpo. El doctor Aaron Kesselheim, de la Universidad de Harvard, lo llama "una herramienta subutilizada para la seguridad del paciente".
Para otros, no. Si tu seguro cubre completamente un genérico tradicional a $5, y el genérico autorizado cuesta $15, no tiene sentido pagar más por lo mismo. La decisión no es solo médica, también es económica y logística.
Lo que sí es claro: si tu médico te recetó un medicamento de marca y te cambian el nombre del fármaco sin avisarte, pregunta. No asumas que es un genérico tradicional. Podría ser una versión idéntica -y eso podría ser una buena noticia.
¿Qué viene después?
El futuro de los genéricos autorizados es incierto. La propuesta de ley RELIEF Act (H.R. 4086), presentada en mayo de 2025, exigiría que los genéricos autorizados tengan el mismo precio que los genéricos tradicionales. Si se aprueba, muchas empresas dejarán de producirlos, porque ya no les dará ventaja competitiva.
Al mismo tiempo, el mercado de biosimilares crece. En 2027, se espera que menos del 5% de los nuevos medicamentos genéricos sean autorizados. La tendencia es clara: la industria está dejando atrás esta estrategia de protección de marca, y el gobierno está empujando hacia una competencia más abierta.
Pero mientras existan, los genéricos autorizados siguen siendo la única forma de obtener exactamente el mismo medicamento que te recetaron, sin pagar el precio de marca. Para pacientes con condiciones crónicas, esa certeza puede valer más que el ahorro.
¿Los genéricos autorizados son más seguros que los genéricos tradicionales?
Sí, en términos de composición. Los genéricos autorizados contienen exactamente los mismos ingredientes activos e inactivos que el medicamento de marca. Esto significa que no hay variaciones en la absorción, eficacia o reacciones adversas por cambios en rellenos o colorantes. Para pacientes sensibles -especialmente con enfermedades como epilepsia, trastornos tiroideos o trasplantes-, esto reduce el riesgo de pérdida de control de la enfermedad. Los genéricos tradicionales, aunque aprobados por la FDA, pueden tener diferentes ingredientes inactivos, lo que en casos raros causa reacciones.
¿Por qué mi farmacia me da un genérico tradicional si el autorizado es idéntico?
Porque tu seguro o tu administradora de beneficios (PBM) negocia mejores descuentos con los fabricantes de genéricos tradicionales. Aunque el genérico autorizado es idéntico, su precio no baja tanto como el de los genéricos tradicionales, porque lo produce la misma empresa que vende la marca. Las PBMs prefieren los genéricos más baratos, incluso si no son idénticos, porque les dan más rebajas. No es una decisión médica, es una decisión de negocio.
¿Cómo sé si un medicamento es genérico autorizado y no un biosimilar?
Los biosimilares tienen sufijos distintivos en su nombre, como -dssb, -nxxp, -aauz o -ktec. Estos nombres se asignan por la FDA para indicar que son productos biológicos diferentes, aunque similares. Los genéricos autorizados no tienen sufijos: su nombre es exactamente el mismo que el del medicamento de marca, solo que sin el nombre comercial. Por ejemplo, si el medicamento es "Stelara", su genérico autorizado se llamaría simplemente "ustekinumab" con el nombre del fabricante, mientras que un biosimilar sería "ustekinumab-aauz".
¿Puedo pedir específicamente un genérico autorizado en mi farmacia?
Sí, puedes pedirlo. Di claramente: "Quiero el genérico autorizado de [nombre de la marca]". Si el farmacéutico no lo tiene, puede solicitarlo. Pero prepárate: puede que no lo tengan en stock, o que tu seguro no lo cubra. En esos casos, puedes pedirle a tu médico que escriba "no sustituir" en la receta. Eso obliga a la farmacia a darte exactamente lo que se recetó.
¿La FDA actualiza su lista de genéricos autorizados con frecuencia?
Sí, la FDA publica la lista oficial de genéricos autorizados cada trimestre. La última actualización fue el 10 de octubre de 2025. Sin embargo, la lista no refleja la fecha exacta en que un producto entró al mercado, sino el período cubierto por los informes anuales de las empresas. Si buscas un medicamento específico, lo mejor es revisar la lista directamente en el sitio de la FDA o preguntar a tu farmacéutico que verifique en el "Orange Book".


Nina Alcantara
diciembre 8, 2025 AT 22:40El concepto de genérico autorizado es un avance farmacéutico subestimado. Técnicamente, es una extensión del NDA original, no un ANDA, lo que implica una equivalencia farmacéutica absoluta, no solo bioequivalencia. La FDA lo define claramente en la guía de 2021 sobre "Same-Product Generic Versions". La confusión surge porque los PBMs y las farmacias no discriminan en el sistema de reembolso, lo que diluye su valor terapéutico real.
En pacientes con epilepsia refractaria o trasplantes, donde la variabilidad en excipientes puede desencadenar crisis o rechazo, este tipo de genérico no es una opción, es un estándar de cuidado. La industria lo está abandonando no por falta de demanda, sino por presión regulatoria y rentabilidad manipulada.
La ley RELIEF Act, si se aprueba, sería un retroceso estratégico. No se trata de precios, se trata de seguridad farmacológica. El paciente merece saber que lo que toma es idéntico, no "similar".
El hecho de que solo haya dos nuevos en 2025 refleja una captura del mercado por parte de los titulares de NDA, no una falta de necesidad clínica.
Jose Reyes
diciembre 10, 2025 AT 20:25Esto es una estafa organizada. Las farmacéuticas crean un genérico autorizado para hacerse más dinero, no para ahorrarle al paciente. ¿Por qué si es idéntico cuesta 15% menos y no 80%? Porque quieren que creas que estás ahorrando, pero en realidad te están engañando. La FDA está corrompida, y la FTC solo actúa cuando hay un escándalo de millones. Mientras tanto, tú sigues pagando por lo mismo.
Y no me vengas con eso de "es más seguro". Si la FDA lo aprobó, ¿por qué no lo hace con todos? Porque no les interesa. El sistema está diseñado para que ganes menos y ellos ganen más. Y los médicos, que no saben diferenciarlo, lo siguen recetando sin pensar.
JOSUE SUBIRIA LOPEZ
diciembre 11, 2025 AT 14:24Es interesante cómo este tema toca tres mundos: la medicina, la economía y la ética. Los genéricos autorizados no son solo una cuestión de precio, son una cuestión de confianza. Si una persona ha tenido una reacción adversa a un genérico tradicional, el hecho de que el mismo laboratorio produzca la misma fórmula sin cambios es una garantía emocional y fisiológica.
La industria lo ha convertido en un arma de control, pero eso no invalida su utilidad. Lo que falta es transparencia. Que en el empaque pongan: "Este producto es idéntico a [marca] y fue fabricado por la misma empresa". Simple. Directo. Sin jerga.
Y si el seguro no lo cubre, que expliquen por qué. No es justo que una decisión de negocio ponga en riesgo la estabilidad de un paciente crónico.
Joaquin Chaparro
diciembre 13, 2025 AT 12:38La noción de que un genérico autorizado es "más seguro" es un mito propagado por académicos con intereses en la industria. La FDA aprueba cualquier cosa con suficientes datos de laboratorio. La bioequivalencia no es igual a identidad clínica. Los excipientes, aunque no afecten la farmacocinética, pueden alterar la farmacodinamia en poblaciones sensibles. Además, el hecho de que sea el mismo laboratorio no garantiza que la línea de producción sea la misma. ¿Quién verifica eso? Nadie.
Y la comparación con biosimilares es absurda. Un biosimilar es un producto biológico complejo; un genérico autorizado es una copia de un fármaco químico simple. No hay equivalencia conceptual. Estás confundiendo categorías para justificar una preferencia irracional.
Miquel Batista
diciembre 14, 2025 AT 01:55Todo esto es un montaje. ¿Sabes quién controla la FDA? Las mismas farmacéuticas que crean los genéricos autorizados. Ellos crean la lista, ellos deciden qué entrar, ellos presionan para que la FTC no actúe hasta que el daño está hecho. Y ahora, con la caída de aprobaciones en 2025, es obvio: están preparando el terreno para que solo los biosimilares sobrevivan, porque esos son más caros, más complejos, y más fáciles de controlar.
¿Por qué no hay más genéricos autorizados? Porque si los hubiera, la gente se daría cuenta de que todo es una farsa. La marca no es calidad, es marca. Y ellos quieren que sigas pagando por el nombre.
La ley RELIEF Act? Es un truco. Quieren que te acostumbres a pagar más por lo mismo, y luego decir que "la competencia es mala". Están jugando con tu salud.
Valina Martinez
diciembre 15, 2025 AT 02:11Si tu medicamento te funciona, no lo cambies. Punto.
Si no sabes qué tienes, pregunta. No asumas. No te asustes. Solo pregunta.
Laura Otto
diciembre 15, 2025 AT 12:46Claro, claro, "es más seguro". Y yo soy el rey de España. ¿Cuántos pacientes han tenido problemas con los genéricos autorizados? Nadie los reporta porque no los reconocen. ¿Cuántos han tenido efectos secundarios con los genéricos tradicionales? Miles. Pero tú lo ves como una solución mágica porque alguien te lo dijo en un artículo. No eres paciente, eres consumidor de información.
Y lo de que "la farmacia no lo tiene"? Porque no quieren venderlo. No les da beneficio. Y tú, en vez de cuestionar, te resignas. Eso es lo que pasa cuando dejas que otros decidan por ti.
Raúl Ferrer
diciembre 17, 2025 AT 06:04La complejidad de este tema radica en la desconexión entre la ciencia y la logística del mercado. Desde un punto de vista farmacéutico, el genérico autorizado representa la máxima fidelidad terapéutica. Desde el punto de vista administrativo, es un obstáculo para la optimización de costos. Las PBMs priorizan la reducción de gastos, no la continuidad del tratamiento.
El paciente, en medio, se convierte en un número. La solución no es eliminar los genéricos autorizados, sino exigir transparencia en la etiqueta, y que los seguros los cubran con la misma prioridad que los tradicionales. No es un privilegio, es un derecho a la estabilidad clínica.
La FDA debe establecer un sello visual distintivo para estos productos. No podemos depender de que el farmacéutico consulte el Orange Book cada vez que receta.
Blanca Roman-Luevanos
diciembre 17, 2025 AT 16:02La ética médica no puede estar sujeta a los márgenes de beneficio de una corporación. Si un medicamento es idéntico en composición, en eficacia, en seguridad, entonces su precio debe reflejar esa identidad, no la estrategia de mercado. El hecho de que el mismo laboratorio lo produzca y lo venda bajo otro nombre no es una innovación, es una manipulación del sistema.
¿Qué significa ser paciente si no puede confiar en que lo que recibe es lo que necesita? La confusión entre genérico autorizado y genérico tradicional no es un error técnico, es una falla ética.
Y si la ley RELIEF Act obliga a igualar precios, no será una victoria del consumidor, será una victoria del sistema que ya lo domina. Lo que necesitamos no es más regulación, es más honestidad.
Gonzalo Pérez
diciembre 17, 2025 AT 21:15La distinción entre genérico autorizado y genérico tradicional es fundamental para la farmacovigilancia. Los genéricos tradicionales, aunque bioequivalentes, pueden presentar variabilidad en excipientes que, en pacientes con alergias, intolerancias o condiciones metabólicas específicas, generan reacciones adversas no anticipadas. El genérico autorizado elimina esta variable.
La caída en su aprobación no refleja una disminución en la demanda, sino una respuesta estratégica de las empresas farmacéuticas ante el aumento de la vigilancia regulatoria. La FTC ha logrado casos exitosos, pero la presión sigue siendo insuficiente.
La solución no es reemplazarlos por biosimilares, sino exigir que los genéricos autorizados sean incluidos en los formularios de seguros con prioridad máxima, y que su etiquetado sea obligatoriamente claro. El paciente merece saber, sin tener que investigar, qué está tomando.
hernan cortes
diciembre 18, 2025 AT 06:56genérico autorizado? jaja. como si no fuera la misma mierda con otro paquete. todo esto es un truco para que pagues más. la fda no es independiente, está llena de ex-empleados de pfizer. y los que dicen que es más seguro? pues claro, porque lo fabrica la misma empresa... que también fabrica la marca. osea, no hay competencia, es como si apple lanzara un iphone "genérico" y te dijera "es igual, pero más barato". ¿y por qué no es un 80% más barato? porque no quieren que te des cuenta de que siempre te están timando.
la ley relief act? es una farsa. quieren que te acostumbres a pagar caro por lo mismo. y si te quejas, te dicen "es por tu salud". no, es por sus ganancias.
Lorenzo Raffio
diciembre 18, 2025 AT 22:08Me encanta cómo este tema muestra lo contradictorio que es nuestro sistema de salud. Por un lado, tenemos científicos que dicen que el genérico autorizado es la mejor opción para ciertos pacientes. Por otro, tenemos seguros que prefieren el más barato, aunque no sea idéntico.
Lo que falta es comunicación. No es culpa del paciente que no sepa la diferencia. Es culpa del sistema que no lo hace fácil. Si en el empaque pusieran: "Este es el mismo medicamento que Zoloft, hecho por Pfizer", nadie se confundiría.
Y si tu seguro no lo cubre, no es que no lo necesites. Es que el sistema no te está sirviendo bien. Pregúntale a tu médico. Pídelo. No te rindas. No es solo medicina, es tu derecho a saber qué estás tomando.
Isidoro Avila
diciembre 19, 2025 AT 05:18La clave está en la transparencia y la educación. Los genéricos autorizados no son una excepción, son la regla ideal en medicina personalizada. Cuando un paciente ha experimentado inestabilidad con genéricos tradicionales, la opción idéntica no es un lujo, es una necesidad clínica.
La industria lo ha convertido en un producto de nicho por razones económicas, pero eso no lo hace menos válido. Lo que debemos exigir es que los formularios de seguros lo prioricen en casos de índice terapéutico estrecho, y que las farmacias lo identifiquen en el sistema de dispensación.
El paciente no debe ser un detective de su propia medicación. La responsabilidad es del sistema, no de él.
Carmen de la Torre
diciembre 20, 2025 AT 22:45La terminología "genérico autorizado" es un oxímoron conceptualmente inaceptable. Un genérico, por definición, es una copia. Si es idéntico, no es genérico, es el mismo producto. La FDA ha cometido un error semántico que confunde al profesional y al paciente por igual.
Además, el hecho de que sea producido por la misma empresa invalida cualquier pretensión de competencia. No es un genérico, es una estrategia de marketing disfrazada de innovación.
La industria ha logrado, mediante esta nomenclatura, mantener el monopolio bajo una fachada de beneficencia. Es un logro de ingeniería de mercado, no de salud pública.
Jaime Mercant
diciembre 22, 2025 AT 19:02yo pedí el genérico autorizado de Lyrica y me dieron el otro... me enojé tanto que llamé a la farmacia y les dije "no es lo mismo". me dijeron que era lo mismo... pero yo sé que no. el empaque era distinto, el sabor era distinto, y me dio más sueño.
no me digas que es lo mismo si yo lo siento distinto. la ciencia puede decir lo que quiera, pero mi cuerpo sabe lo que necesita.
por favor, si vas a cambiar mi medicamento, al menos avísame. 🙏
JOSUE SUBIRIA LOPEZ
diciembre 23, 2025 AT 17:18El comentario de Jaime es un ejemplo perfecto de por qué este debate importa. La percepción subjetiva del paciente no es "irracional", es una señal clínica real. Las variaciones en excipientes, aunque mínimas, pueden alterar la cinética de absorción en el tracto gastrointestinal, especialmente en pacientes con trastornos digestivos o en quienes toman múltiples fármacos.
La medicina basada en la evidencia debe incluir la experiencia del paciente, no ignorarla. Si un paciente reporta cambios, no se trata de "creer en lo que siente", se trata de investigar por qué lo siente.
Y si el sistema no responde, entonces el problema no es el paciente. Es el sistema.